اسید سولفوریک چیست

نگاه کلی
اسید سولفوریک اسید معدنی بسیار قوی میباشد. این اسید با هر درصدی در آب حل میشود. اسید سولفوریک در گذشته به نام جوهر گوگرد معروف بوده است. وقتی غلظت بالایی از گازی به اسید سولفوریک اضافه میشود، الئوم یا اسید سولفوریک دود کننده به فرمول
گازی به اسید سولفوریک اضافه میشود، الئوم یا اسید سولفوریک دود کننده به فرمول 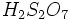 ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا
میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر
حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود.
ایجاد میشود. واکنش اسید سولفوریک با آب بسیار گرمازا
میباشد. اضافه کردن آب به اسید سولفوریک غلیظ خطرناک است. زیرا در اثر
حرارت حاصل از واکنش اسید و آب ، آب داغ ممکن است به اطراف پراکنده شود.بنابراین آن را با آرامی به آب اضافه میکنند. این مساله بدلیل پایین بودن دانسیته آب نسبت به اسید سولفوریک میباشد که آب میل دارد روی اسید قرار گیرد. میل ترکیبی اسید سولفوریک با آب بقدری بالاست که میتواند مولکولهای هیدروژن و اکسیژن را از بقیه ترکیبات بصورت آب جدا کند. به عنوان مثال مخلوط کردن گلوکز و اسید سولفوریک ، عنصر کربن و آب ایجاد میکند.
اسید سولفوریک قسمت عمده باران اسیدی میباشد که از آ لا یندههای جوی مثل
 حاصل از کارخانهها با آب باران بوجود میآید.
حاصل از کارخانهها با آب باران بوجود میآید.

تاریخچه :
اسید سولفوریک در قرن نهم توسط شیمیدان ایرانی به نام زکریای رازی کشف شد. او اسید سولفوریک را از طریق تقطیر خشک کانیهایی که شامل سولفات آهن  که زاج سبز نامیده میشود و سولفات مس
که زاج سبز نامیده میشود و سولفات مس 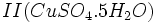 که کات کبود نامیده میشد بدست آورد. حرارت هر یک از این ترکیبات باعث تجزیه آنها و ایجاد اکسید آهن II یا اکسید مس II ، آب و
که کات کبود نامیده میشد بدست آورد. حرارت هر یک از این ترکیبات باعث تجزیه آنها و ایجاد اکسید آهن II یا اکسید مس II ، آب و 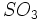 میگردد. ترکیب آب و
میگردد. ترکیب آب و  حاصل شده ، محلول رقیق اسید سولفوریک ایجاد میکند.
حاصل شده ، محلول رقیق اسید سولفوریک ایجاد میکند.
این روش با ترجمه متون علمی و کتابهای دانشمندان ایرانی توسط شیمیدانهای اروپایی درقرون وسطی مانند آلبرت ماگنوس دراروپا شناخته شد و به این دلیل اسید سولفوریک را شیمیدانهای قرون وسطی به نام جوهر گوگرد شناختند.
در قرن هفدهم ، جان گلوبر ، اسید سولفوریک را از سوزاندن سولفورو نیترات پتاسیم در مجاورت بخار آب تهیه کرد. در سال 1746 ، جان روبک اسید سولفوریک را با غلظت 40-35% در ظروف سربی تولید میکرد. جوزف گیلوساک با اصلاح روش روبک ، اسید سولفوریکی با غلظت 78% بدست آورد.
با این همه صنایع رنگرزی و سایرصنایع شیمیایی خواهان اسید سولفوریک با غلظت بالاتر بودند. در اواسط قرن 18 این امر با
روش تقطیر خشک کانیها ، شبیه همان روش اولیه رازی ممکن شد. در این روش سولفید آهن در اثر حرارت در هوا تولید سولفات آهن II میکند و فراورده حاصل با حرارت اضافی اکسید شده و تولید سولفات آهن III میکند که آن هم در اثر حرارت در 480 درجه سانتیگراد تجزیه شده و اکسید آهن و  ایجاد میکند. عبور دادن
ایجاد میکند. عبور دادن  به آرامی از میان آب ، اسید سولفوریک با غلظت بالا ایجاد میکند.
به آرامی از میان آب ، اسید سولفوریک با غلظت بالا ایجاد میکند.
کاربرد اسید سولفوریک
اسید سولفوریک جزء مواد شیمیایی پراستفاده میباشد. این ماده درواکنشهای شیمیایی و فرآیندهای تولید سایر ترکیبات ، کابرد فراوانی دارد. عمدهترین استفاده آن در کارخانههای تولید کود شیمیایی ، استخراج فلزات ، سنتزهای شیمیایی ، تصفیه پسابها و پالایشگاههای نفت میباشد. اسید سولفوریک در اثر واکنش با اسید نیتریک ، یون نیترونیوم تولید میکند که در فرآیند نیترودار کردن ترکیبات استفاده میشود.فرآیند نیترودار کردن در صنایع تولید مواد منفجره مانند تولید ترینیتروتولوئن (TNT) ، نیتروگلسیرین و ... استفاده میشود. اسید سولفوریک در انبارههای سربی (باطریهای سربی) به عنوان محلول الکترولیت استفاده میشود.
اسید سولفوریک ، یک عامل آبگیری بسیار قوی است. در اکثر واکنشها به عنوان عامل هیدراتاسیون استفاده میشود و در تولید میوههای خشک هم به میزان کم ، از اسید سولفوریک برای جذب آب استفاده میکنند.
تولید اسید سولفوریک به روش تماسی
در سال 1832 یک تاجر انگلیسی سرکه ، روشی اقتصادی برای تولید و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و
قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در
سه مرحله صورت میگیرد که عبارتند از :
و اسید سولفوریک غلیظ ابداع کرد که امروزه به نام فرآیند تماسی معروف است و
قسمت اعظم اسید سولفوریک در دنیا به این روش تولید میگردد. این فرآیند در
سه مرحله صورت میگیرد که عبارتند از :- تهیه و خالص سازی
 :
:
خالص سازی و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند.
و هوا برای جلوگیری از مسمومشدن کاتالیزور لازم است. گازها پس از شستشو با آب ، با اسید سولفوریک خشک میشوند.
- اکسیداسیون کاتالیکی
 به
به  :
:
 با
با 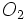 در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و
در دمای بالاتر از 450 درجه سانتیگراد و فشار 2atm و کاتالیزور پنتا اکسید وانادیم ، واکنش داده و  تولید میکند.
تولید میکند.  تولید شده از میان تبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال
تولید شده از میان تبادلگر گرمایی عبور داده شده و در اسید سولفوریک غلیظ حل شده و تولید الئوم میکند. به دلیل اینکه انحلال  در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم
در آب بسیار گرمازا بوده و بجای اسید سولفوریک مایع ، مه تولید میشود، انحلال مستقیم  در آب عملی نمیباشد.
در آب عملی نمیباشد.
- تولید
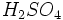 :
:
اولئوم با آب واکنش داده و اسید سولفوریک تولید میکند.
|
| |
خواص فیزیکی
| |
| اسید سولفوریک | نام |
| H2SO4 | فرمول |
| مایع بیرنگ | ظاهر |
| 98gr/mol | وزن مولکولی |
| 10 درجه سانتیگراد | دمای ذوب |
| 337 درجه سانتیگراد | نقطه جوش |
| 1.8gr/cm3 | دانسیته |
نکات ایمنی
اسید سولفوریک ، اسید بسیار قوی و خورنده میباشد. نوشیدن آن باعث آسیبهای شدید دائمی در دهان و سایر بافتهای مورد تماس میشود. تنفس آن بسیار خطرناک بوده و باعث آسیبهای جدی میشود. در صورت تماس با پوست و چشم باعث سوزش و ایجاد زخم میشود. در صورت تماس پوست و چشم با آن ، باید با آب فراوان شستشو داده و سپس از محلول بیکربنات سدیم یک درصد برای شستشو موضع مورد تماس استفاده گردد.کیمیای صنعت یکی از مراکز فروش اسید سولفوریک به صورت گالن 20 لیتری ، بشکه200 لیتری ، مخزن 1000 لیتری و بیشتر میباشد.
جهت اطلاعات بیشتر با کیمیای صنعت تما س بگیرید
راهها ی ارتباطی :
تلفن تهران : 55311128 – 021
56542942 - 021
56543059 - 021
تلفن انبار کهریزک 60 متری شورآباد : 56544728 - 021
فکس : 56544729 - 021
همراه : 09193126838 - 09125772342
تلفن اراک : 33248657 - 086
33280282 – 086
فاکس : 33257149 – 086
همراه : 09183494533
ارسال پیام : 10002155311128
پست الکترونیکی : info@kimiyayesanat.com
جهت دریافت قیمتها و موجودی مواد و اطلاعات کابردی تخصصی و عمومی عضو تلگرام شوید : https://t.me/kimiyayesanat/243
اینستاگرام : kimiyaye sanat@
